偶联不止ADC,还有RDC | 江湖

在医药巨头和资本的双轮驱动下,放射性核素偶联药物(RDC)迎来加速发展期。
近两年,国内公司在RDC产品研发上动作频频。2021年12月,远大医药与德国ITM公司达成战略合作,以不超过5.2亿欧元的对价,获得3款RDC诊断产品在大中华区的独家权利。去年底至今,数家拥有RDC管线的公司密集完成融资:先通医药获得 3.2 亿元D+轮融资;辐联医药完成1,000万美元种子轮融资、2.5亿元人民币A轮融资;艾博兹医药获得7,500万美元A轮融资。
在全球范围内,据投资机构统计,2021年靶向放射疗法领域产生超12项股权投资,2022年前8个月又有9笔投资完成。
肿瘤诊疗一体化
RDC在药物结构上与抗体偶联药物(ADC)类似,仍由配体-连接子-载荷三部分组成。稍有区别的是,RDC的载荷为放射性同位素,因此其连接子上需螯合能装载同位素的特定官能团结构(Chelator)。
自2016年以来,FDA已批准9款RDC药物上市,其中7款为肿瘤诊断产品,2款为肿瘤治疗产品。适应症主要涉及前列腺癌和神经内分泌瘤,目标靶点集中于前列腺特异性膜抗原(PSMA)和生长抑素受体(SSTR)。
从获批数据看,RDC诊断产品的数量要显著多于治疗产品。截止目前,仅有镥氧奥曲肽(177Lu-Dotatate)和Pluvicto(177Lu-PSMA-617)两款RDC治疗药物获批上市,均归属于诺华公司。
但目前RDC管线布局正呈现出“诊疗配对(Theranostic pair)”的趋势,即利用同一配体分别开发针对特定靶点的RDC诊断和治疗产品。其中配体与放射性同位素F-18、Ga-68等连接,就构成显像诊断产品,而连接Lu-177、Ac-225等就构成治疗产品。
国外RDC研发的领先公司,如ITM、TELIX、CLARITY等,均已在产品线布局中采用这一策略(见下图ITM产品线)。
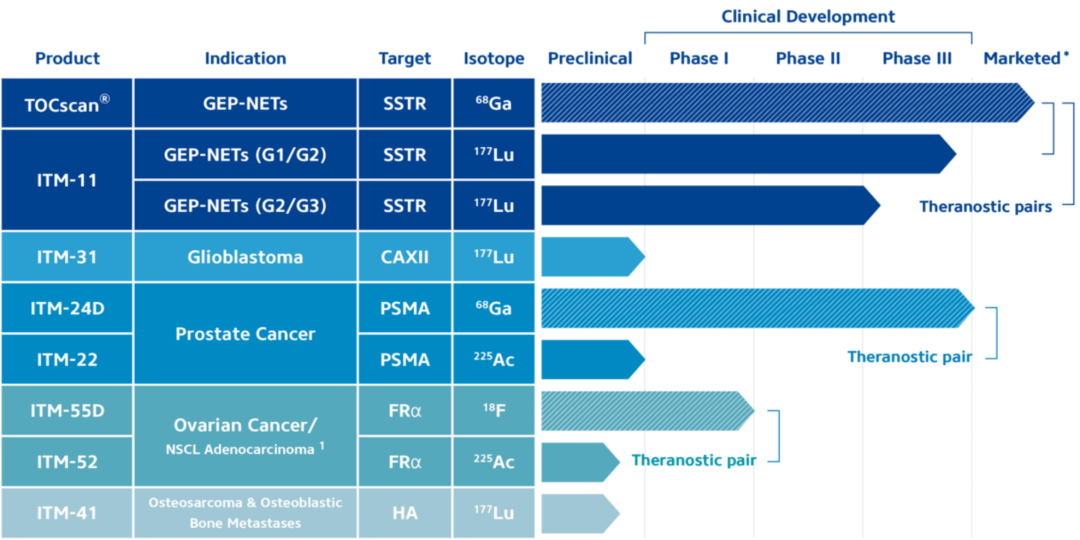
“RDC特有的诊疗配对,可有效构筑肿瘤诊断-治疗-疗效评估闭环。”辐联医药联合创始人丁航海博士举了晚期前列腺癌治疗的例子,“可先使用Ga-68-PSMA等对肿瘤进行显影诊断,随后,依据诊断结果对PSMA阳性患者,使用Lu-177-PSMA等对肿瘤进行打击。治疗完成后还可再利用RDC显像药物判断治疗效果。”
“在这个过程中每一步都实现可视化、可量化,我们能准确知道患者体内突变肿瘤的数量,也能据此确定给药剂量,亦可对疗效作量化评估,这是基因检测等伴随诊断产品无法实现的。”丁航海博士说。
诊疗配对亦可提升RDC使用的安全性。RDC使用过程也存在脱靶问题,但丁航海博士表示,鉴于RDC的特点,其脱靶数量、放射性元素脱靶后的分布及体内代谢情况,均可以示踪和量化。
同时,由于一般放射性同位素在细胞外即可发挥治疗作用,因此RDC药物起效过程偶联物无需断裂,这提高了其在体内的稳定性和安全性,也使其除可靶向突变细胞外,还能对肿瘤中没有突变的异质细胞也产生杀伤作用(cross-fire effect)。
寻求产品差异点
RDC在肿瘤精准治疗方面具备多项优势,但其在国内仍属新生事物,仅有来自远大医药、诺华等屈指可数的RDC产品在中国递交临床研究申请。值得一提的是,近两年有国内新进生物技术公司往该方向发力,并实现后来者居上。
丁航海博士所在的辐联医药,从2021年8月成立于至今刚一年,公司管线已有两款产品推进到临床前研究阶段,其预计明年3~4季度可以在欧美启动首次人体研究。
辐联医药的三位创始人——丁航海博士、黄仲廉博士和孙沛淇先生,在RDC诊断产品研发及生物技术公司管理方面积累的经验,为辐联布局RDC治疗产品开发及放射性同位素生产带来了得天独厚的优势。



从左至右:孙沛淇先生、丁航海博士、黄仲廉博士
来源 | 辐联医药官网
辐联医药成立前,丁航海博士与黄仲廉博士一同在和迈生物(NanoMab Technology )从事RDC诊断产品研发,丁航海博士亦是和迈生物的创始人之一。和迈有两款产品已推进至临床研究阶段,分别是NM-01锝标记的抗PD-L1单域抗体,以及NM-02锝标记的HER2单域抗体。
NM-01是全球首个获批开展临床研究的PD-L1显像RDC药物,现在开展Ⅱ期临床研究,该产品已于2019年6月与美国影像公司Lantheus Medical Imaging签订授权协议。除此以外,和迈生物其他产品也于去年悉数对外转让。
据丁航海博士介绍,配体和偶联剂设计是RDC药物的核心技术,而该技术在RDC药物和RDC诊断产品中是相通的。和迈生物在研发过程中积累的大量配体和偶联剂开发经验,因而得以平移至辐联医药。
而辐联医药的另一位创始人孙沛淇先生,曾担任全球生命科学风投公司Gordian Ventures的合伙人兼首席投资官,也是AI药物设计公司硅康医药(Silicon Therapeutics)的联合创始人。2021年4月硅康医药被Roivant收购,总交易规模达20.5亿美元。
据辐联医药网站公布的信息,其已在FAP、Claudin18.2及GCC三个靶点上布局产品研发。资料显示,FAP在多种恶性实体瘤微环境中高表达,已有多家公司针对这一靶点开发RDC诊断产品;Claudin18.2主要是在胰腺癌和胃癌高表达;GCC主要在直肠癌高表达。这些目前都还是临床治疗中棘手的肿瘤。
丁航海博士认为:“RDC可以开发的靶点并没有太多限制,理论上ADC药物可以开发的靶点,RDC也都能尝试而且它还有诊疗一体化的优势。”

丁航海博士还提到,辐联医药的产品开发还有一个创新点,即尝试使用同样的配体,偶联不同放射性元素来开发多款产品,如FAP配体分别与Lu-177或Ac-225偶联,以适应于不同的肿瘤治疗场景。
“Lu-177产生的是β粒子射线,穿透性强杀伤力相对较弱,而Ac-225产生的是α粒子射线,穿透性弱但杀伤力更强。”丁航海博士说,“我们可以根据病人不同的分期及肿瘤大小来选择同位素标记,β射线能够穿透体积较大的肿瘤,而α射线可用于打击广泛转移病灶,而不会过多破坏周围的正常组织。也可根据需要,对病人采用多种同位素联用的治疗方案,可能实现更好的治疗效果。“
抓产业链痛点
除了开发RDC治疗药物,辐联医药还计划在比利时建造加速器设备,自主开展Alpha和Beta治疗型放射性同位素的生产,这也是辐联医药与其他RDC产品研发公司的另一差异化之处。
RDC产业上游供应链,主要涉及配体、偶联物和医用同位素3个部分,其中医用同位素生产是现阶段中国发展核药的关键瓶颈,国内临床使用的多数放射性同位素都需要依赖国外进口。为此,2021年5月国家多部委还曾专门联合印发《医用同位素中长期发展规划》,旨在促进医用同位素产品的研发生产。
“医用同位素半衰期通常较短,例如Lu-177的半衰期是6.7天、Ac-225的半衰期是9.9天,如果没有专门设施用于医用同位素的定时生产,病人就无法及时用上治疗产品。”丁航海博士提到,辐联医药打算自建生产设施,保证核素在大规模临床阶段的供应,从而保证临床开发和商业化的顺利进行。这也是跟全球很多核药开发公司相比,辐联的一个主要的优势和亮点。
辐联医药准备开发的产品主要涉及Lu-177和Ac-225两种同位素。由于Lu-177的生产需要建造反应堆,且国际上Lu-177供应相对充足,因此Lu-177辐联医药选择从供应商采购,而Ac-225将由自主建造的加速器生产。
此前中国核技术网也曾对Ac-225做过介绍,称其为“世界上最稀有的药物”。该介绍提到,目前全球生产的Ac-225每年也只够少数几位患者治疗使用。
丁海航博士表示,辐联医药在同位素生产设备建造及运行相关的人才方面,已有适当储备。“辐联生产团队成员此前均参与过不同医用同位素生产,也包括Ac-225的小规模生产,对加速器的运作方式、靶件设计与冷却系统和同位素分离技术有深入了解。”
而辐联选择在比利时建造加速器设施和核药房,是出于比利时专家在加速器生产同位素、国际运输放射性药品方面经验丰富,同时也因为欧洲在核药开发和应用方面有悠长的历史和经验。辐联短中期开发药品的主要临床基地和市场在欧美,比利时的设施将为此提供重要的支持。
辐联医药估计最终投入运行时,GMP工厂项目投入会超过1亿美元。其计划可以在3年左右建成并投入使用。
“预计加速器正式投产时,辐联医药会有3~4个产品已处于临床研究阶段,产品线还会有更多早期产品推出。”在丁航海博士眼里,3年时间足够让辐联医药完成蜕变,曾经他从和迈生物创立到成功退出也只经过6年时间,但这次辐联医药准备在核药领域下一盘更大的棋,他也十分期待与国内外制药公司合作,开展产品在全球层面上的临床研究。

